Dalam kehidupan sehari-hari, arus listrik yang dihasilkan dari suatu reaksi kimia dalam sel volta banyak kegunaannya, seperti untuk radio, kalkulator, televisi, kendaraan bermotor, dan lain-lain.Sel volta dalam kehidupan sehari-hari ada dalam bentuk berikut.
a. Sel Baterai
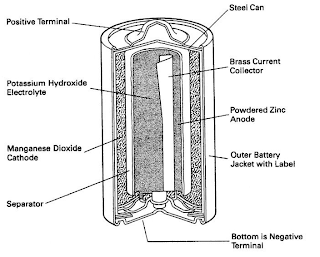
1) Baterai Biasa
Baterai yang sering kita gunakan disebut juga sel kering atau sel Lecanche. Dikatakan sel kering karena jumlah air yang dipakai sedikit (dibatasi). Sel ini terdiri atas:
Anode : Logam seng (Zn) yang dipakai sebagai wadah.
Katode : Batang karbon (tidak aktif).
Elektrolit : Campuran berupa pasta yang terdiri dari MnO2,NH4Cl, dan sedikit air.
Reaksi:
Anode : Zn(s) --->Zn2+(aq) + 2 e–
Katode :2 MnO2(s) + 2 NH4+(aq) + 2 e–--->Mn2O3(s) + 2 NH3(g) + H2O(l)

2) Baterai Alkaline
Pada baterai alkaline dapat dihasilkan energi dua kali lebih besar dibanding baterai biasa. Sel ini terdiri atas:
Anode : Logam seng (Zn) yang sama seperti baterai biasa digunakan sebagai wadah.
Katode : Oksida mangan (MnO2 ).
Elektrolit : Kalium hidroksida (KOH).
Reaksi:
Anode : Zn(s)---> Zn2+(aq) + 2 e–
Katode : 2 MnO2+ H2O + 2 e–--->Mn2O3 + 2 OH–
Ion Zn2+ bereaksi dengan OH– membentuk Zn(OH) .
b. Sel Aki
Sel aki atau accu merupakan contoh sel volta yang bersifat reversibel, di mana hasil reaksi dapat diubah kembali menjadi zat semula. Pada sel aki jika sudah lemah dapat diisi ulang, sedangkan
pada sel baterai tidak bisa.
Sel ini terdiri atas:
Anode : Lempeng logam timbal (Pb).
Katode : Lempeng logam oksida timbal (PbO2).
Ektrolit : Larutan asam sulfat (H2SO4) encer.
Reaksi pengosongan aki:
Anode : Pb(s) ++ H2SO4 (aq) ---> PbSO4(s) + H+(aq) + 2 e–
Katode :PbO2(s) + SO4-2 (aq)+ 3 H+(aq) + 2 e– --->PbSO4(aq) + 2 H2O
______________________________________________________________+
Reaksi lengkapnya:Pb(s) + PbO2(s) + 2SO4-2 (aq) + 2 H+(aq)---> 2 PbSO4(s) + 2 H2O (l)
Ketika sel ini menghasilkan arus listrik, anode Pb dan katode PbO2
berubah membentuk PbSO4. Ion H+ dari H2SO4 berubah membentuk H2O sehingga konsentrasi H2SO4 akan berkurang. Kemudian sel aki dapat diisi/disetrum kembali, sehingga konsentrasi asam sulfat kembali seperti semula. Proses ini nanti merupakan contoh dalam sel elektrolisis.

Sumber: Infinitecables

thanks infonya bu...
BalasHapusoh ya apakah adalagi bu selain yg diatas ?
regard
rulypirata.blogspot.com
makasih infonya.. sangat bermanfaat & membantu saya dlam belajar ilmu kimia :)
BalasHapusinformasi dalam blog ini sungguh sangat kaya akan pengetahua dan wawasan baru ygmungkin blom di dapat di buku pada umumnya.
BalasHapusterima kasih infonya, sukses selalu
BalasHapusoke
BalasHapus