Seorang ahli dari Inggris bernama Michael Faraday mengalirkan arus listrik ke dalam larutan elektrolit dan ternyata terjadi suatu reaksi kimia. Proses penggunaan arus listrik untuk menghasilkan reaksi kimia disebut sel elektrolisis.
Arus listrik ini bisa berasal dari sel volta.
Dalam setiap ketentuan reaksi elektrolisis terjadi persaingan antarspesi (ion atau molekul) untuk mengalami reaksi reduksi atau reaksi oksidasi. Setiap zat yang mempunyai kemampuan reduksi besar akan mengalami reaksi reduksi dan setiap zat yang mempunyai kemampuan oksidasi besar akan mengalami reaksi oksidasi.
A. Sel Elektrolisis Bentuk Lelehan/Cairan/Liquid
Sel bentuk ini hanya berlaku untuk senyawa ionik dengan tidak ada zat
pelarut (tidak ada H2O). Hanya ada kation dan anion.
Katode : Kation langsung direduksi (X+ (aq) + e–---> X(s))
Anode : Anion langsung dioksidasi (Y(s) ---> Y+ (aq) + e–).
Kation golongan utama atau golongan transisi langsung direduksi.
Contoh soal
1. Tuliskan reaksi elektrolisis cairan NaCI dengan elektrode platina!
Jawab:
NaCl(l)---> Na+ + Cl–............................................ × 2
Katode (Pt) : Na+ + e–--->Na(s) ................... × 2
Anode (Pt) : 2 Cl– ---->Cl2(g) + 2 e–............... × 1
2 NaCl(l) --->2 Na(s) + Cl2 (g)
2. Tuliskan reaksi elektrolisis lelehan Ag2O dengan elektrode Pt!
Jawab:
Ag2O(l)---> 2 Ag+ + O2–....................................... × 2
Katode (Pt) : 2 Ag+ + 2 e–---> 2 Ag(s) ............... × 2
Anode (Pt) : 2 O2– --->O2(g) + 4 e– ............... × 1
2 Ag2O(l)---> 4 Ag(s) + O2(g)
Selasa, 11 Oktober 2011
Korosi
Korosi adalah teroksidasinya suatu logam. Dalam kehidupan seharihari, besi yang teroksidasi disebut dengan karat dengan rumus Fe2O3· xH2O.
Proses perkaratan termasuk proses elektrokimia, di mana logam Fe yang teroksidasi bertindak sebagai anode dan oksigen yang terlarut dalam air yang ada pada permukaan besi bertindak sebagai katode.
Reaksi perkaratan:
Anode : Fe --->Fe2+ + 2 e–
Katode : O2 + 2 H2 O + 4 e– --->4 OH–
Fe2+ yang dihasilkan, berangsur-angsur akan dioksidasi membentuk Fe3+.
Sedangkan OH– akan bergabung dengan elektrolit yang ada di alam atau dengan ion H+ dari terlarutnya oksida asam (SO2, NO2) dari hasil perubahan dengan air hujan. Dari hasil reaksi di atas akan dihasilkan karat dengan rumus senyawa Fe2O3·xH2O. Karat ini bersifat katalis untuk proses perkaratan berikutnya yang disebut autokatalis.
a. Kerugian
Besi yang terkena korosi akan bersifat rapuh dan tidak ada kekuatan.
Ini sangat membahayakan kalau besi tersebut digunakan sebagai pondasi bangunan atau jembatan. Senyawa karat juga membahayakan kesehatan, sehingga besi tidak bisa digunakan sebagai alat-alat masak, alat-alat industri makanan/farmasi/kimia.
b. Pencegahan
Pencegahan besi dari perkaratan bisa dilakukan dengan cara berikut.
1) Proses pelapisan
Besi dilapisi dengan suatu zat yang sukar ditembus oksigen. Hal ini dilakukan dengan cara dicat atau dilapisi dengan logam yang sukar teroksidasi. Logam yang digunakan adalah logam yang
terletak di sebelah kanan besi dalam deret volta (potensial reduksi lebih negatif dari besi). Contohnya: logam perak, emas, platina, timah, dan nikel.
2) Proses katode pelindung (proteksi katodik)
Besi dilindungi dari korosi dengan menempatkan besi sebagai katode, bukan sebagai anode. Dengan demikian besi dihubungkan dengan logam lain yang mudah teroksidasi, yaitu logam di sebelah kiri besi dalam deret volta (logam dengan potensial reduksi lebih
positif dari besi). Hanya saja logam Al dan Zn tidak bisa digunakan karena kedua
logam tersebut mudah teroksidasi, tetapi oksida yang terbentuk (A12O3/ZnO) bertindak sebagai inhibitor dengan cara menutup rapat logam yang di dalamnya, sehingga oksigen tidak mampu masuk dan tidak teroksidasi. Logam-logam alkali, seperti Na, K juga tidak
bisa digunakan karena akan bereaksi dengan adanya air. Logam yang paling sesuai untuk proteksi katodik bisa digunakan karena akan bereaksi dengan adanya air. Logam yang paling sesuai untuk proteksi katodik adalah logam magnesium (Mg). Logam Mg di sini
bertindak sebagai anode dan akan terserang karat sampai habis, sedang besi bertindak sebagai katode tidak mengalami korosi.
Proses perkaratan termasuk proses elektrokimia, di mana logam Fe yang teroksidasi bertindak sebagai anode dan oksigen yang terlarut dalam air yang ada pada permukaan besi bertindak sebagai katode.
Reaksi perkaratan:
Anode : Fe --->Fe2+ + 2 e–
Katode : O2 + 2 H2 O + 4 e– --->4 OH–
Fe2+ yang dihasilkan, berangsur-angsur akan dioksidasi membentuk Fe3+.
Sedangkan OH– akan bergabung dengan elektrolit yang ada di alam atau dengan ion H+ dari terlarutnya oksida asam (SO2, NO2) dari hasil perubahan dengan air hujan. Dari hasil reaksi di atas akan dihasilkan karat dengan rumus senyawa Fe2O3·xH2O. Karat ini bersifat katalis untuk proses perkaratan berikutnya yang disebut autokatalis.
a. Kerugian
Besi yang terkena korosi akan bersifat rapuh dan tidak ada kekuatan.
Ini sangat membahayakan kalau besi tersebut digunakan sebagai pondasi bangunan atau jembatan. Senyawa karat juga membahayakan kesehatan, sehingga besi tidak bisa digunakan sebagai alat-alat masak, alat-alat industri makanan/farmasi/kimia.
b. Pencegahan
Pencegahan besi dari perkaratan bisa dilakukan dengan cara berikut.
1) Proses pelapisan
Besi dilapisi dengan suatu zat yang sukar ditembus oksigen. Hal ini dilakukan dengan cara dicat atau dilapisi dengan logam yang sukar teroksidasi. Logam yang digunakan adalah logam yang
terletak di sebelah kanan besi dalam deret volta (potensial reduksi lebih negatif dari besi). Contohnya: logam perak, emas, platina, timah, dan nikel.
2) Proses katode pelindung (proteksi katodik)
Besi dilindungi dari korosi dengan menempatkan besi sebagai katode, bukan sebagai anode. Dengan demikian besi dihubungkan dengan logam lain yang mudah teroksidasi, yaitu logam di sebelah kiri besi dalam deret volta (logam dengan potensial reduksi lebih
positif dari besi). Hanya saja logam Al dan Zn tidak bisa digunakan karena kedua
logam tersebut mudah teroksidasi, tetapi oksida yang terbentuk (A12O3/ZnO) bertindak sebagai inhibitor dengan cara menutup rapat logam yang di dalamnya, sehingga oksigen tidak mampu masuk dan tidak teroksidasi. Logam-logam alkali, seperti Na, K juga tidak
bisa digunakan karena akan bereaksi dengan adanya air. Logam yang paling sesuai untuk proteksi katodik bisa digunakan karena akan bereaksi dengan adanya air. Logam yang paling sesuai untuk proteksi katodik adalah logam magnesium (Mg). Logam Mg di sini
bertindak sebagai anode dan akan terserang karat sampai habis, sedang besi bertindak sebagai katode tidak mengalami korosi.
Label:
Reaksi Oksidasi Reduksi
Senin, 22 Agustus 2011
Ulangan Struktur Atom dan SPU 2 (kelas XIA)
A
Jawablah pertanyaan di bawah ini
- a.Tulislah konfigurasi elektron singkat unsur X(nomer atom= 25)
b. Tulislah konfigurasi elektron X+2 dengan nomer atom 20
- Bilangan kuantum terakhir suatu unsur adalah n= 3. l= 2, m =+1, s = +1/2. Tentukan nomer atomnya
- Bilangan kuantum terakhir suatu unsur adalah n= 2 . l= 1 , m =1 , s = - ½. Tentukan nomer atomnya
- Tentukan bilangan kuantum elektron terakhir dari unsur Y dengan nomer atom 33
- Tentukan letak golongan dan periode dari
- 22 Ti
- 31 Ga
- Ramalkan bentuk molekul dari
a.NF3 dengan teori domain( nomor atom N=7, F=9)
b.SCl6 dengan teori hibridisasi(nomor atom S=16, Cl= 17)
Dan gambarkan molekulnya
- Gambarkan ikatan hidrogen dalam molekul H2O
- Prediksikan konfigurasi elektron dari Y (periode 5 , golongan II B)
B
Jawablah pertanyaan di bawah ini
- a.Tulislah konfigurasi elektron singkat unsur X(nomer atom=39 )
b. Tulislah konfigurasi elektron X+1 dengan nomer atom 19
- Bilangan kuantum terakhir suatu unsur adalah n= 3. l= 1 , m =0 , s = - ½. Tentukan nomer atomnya
- Bilangan kuantum terakhir suatu unsur adalah n= 2. l= 1 , m =0 , s = - ½. Tentukan nomer atomnya
- Tentukan bilangan kuantum elektron terakhir dari unsur Y dengan nomer atom 24
- Tentukan letak golongan dan periode dari
- 25 Mn
- 35 Br
- Ramalkan bentuk molekul dari
a.CCl4 dengan teori domain( nomor atom C=6, Cl=17)
b.PCl5 dengan teori hibridisasi(nomor atom P=15, Cl= 17)
Dan gambarkan molekulnya
- Gambarkan ikatan hidrogen dalam molekul HF
- Prediksikan konfigurasi elektron dari X (periode 5 , golongan III B)
Label:
Soal-Soal
Minggu, 14 Agustus 2011
Kegunaan Sel Volta
Dalam kehidupan sehari-hari, arus listrik yang dihasilkan dari suatu reaksi kimia dalam sel volta banyak kegunaannya, seperti untuk radio, kalkulator, televisi, kendaraan bermotor, dan lain-lain.Sel volta dalam kehidupan sehari-hari ada dalam bentuk berikut.
a. Sel Baterai
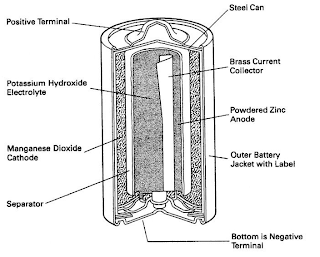
1) Baterai Biasa
Baterai yang sering kita gunakan disebut juga sel kering atau sel Lecanche. Dikatakan sel kering karena jumlah air yang dipakai sedikit (dibatasi). Sel ini terdiri atas:
Anode : Logam seng (Zn) yang dipakai sebagai wadah.
Katode : Batang karbon (tidak aktif).
Elektrolit : Campuran berupa pasta yang terdiri dari MnO2,NH4Cl, dan sedikit air.
Reaksi:
Anode : Zn(s) --->Zn2+(aq) + 2 e–
Katode :2 MnO2(s) + 2 NH4+(aq) + 2 e–--->Mn2O3(s) + 2 NH3(g) + H2O(l)

2) Baterai Alkaline
Pada baterai alkaline dapat dihasilkan energi dua kali lebih besar dibanding baterai biasa. Sel ini terdiri atas:
Anode : Logam seng (Zn) yang sama seperti baterai biasa digunakan sebagai wadah.
Katode : Oksida mangan (MnO2 ).
Elektrolit : Kalium hidroksida (KOH).
Reaksi:
Anode : Zn(s)---> Zn2+(aq) + 2 e–
Katode : 2 MnO2+ H2O + 2 e–--->Mn2O3 + 2 OH–
Ion Zn2+ bereaksi dengan OH– membentuk Zn(OH) .
b. Sel Aki
Sel aki atau accu merupakan contoh sel volta yang bersifat reversibel, di mana hasil reaksi dapat diubah kembali menjadi zat semula. Pada sel aki jika sudah lemah dapat diisi ulang, sedangkan
pada sel baterai tidak bisa.
Sel ini terdiri atas:
Anode : Lempeng logam timbal (Pb).
Katode : Lempeng logam oksida timbal (PbO2).
Ektrolit : Larutan asam sulfat (H2SO4) encer.
Reaksi pengosongan aki:
Anode : Pb(s) ++ H2SO4 (aq) ---> PbSO4(s) + H+(aq) + 2 e–
Katode :PbO2(s) + SO4-2 (aq)+ 3 H+(aq) + 2 e– --->PbSO4(aq) + 2 H2O
______________________________________________________________+
Reaksi lengkapnya:Pb(s) + PbO2(s) + 2SO4-2 (aq) + 2 H+(aq)---> 2 PbSO4(s) + 2 H2O (l)
Ketika sel ini menghasilkan arus listrik, anode Pb dan katode PbO2
berubah membentuk PbSO4. Ion H+ dari H2SO4 berubah membentuk H2O sehingga konsentrasi H2SO4 akan berkurang. Kemudian sel aki dapat diisi/disetrum kembali, sehingga konsentrasi asam sulfat kembali seperti semula. Proses ini nanti merupakan contoh dalam sel elektrolisis.

Sumber: Infinitecables
Label:
Reaksi Oksidasi Reduksi
Prediksi Reaksi dengan Deret Volta
Memperkirakan berlangsungnya suatu reaksi sudah dijelaskan, yaitu dengan menentukan tanda potensial sel. Jika tanda potensial sel positif, maka reaksi berlangsung dan tanda potensial sel negatif, reaksi tidak berlangsung. Dalam perkiraan berikut ini tidak menggunakan perhitungan, tetapi hanya memperkirakan dari unsur-unsur yang terdapat dalam deret volta.
Sumber: Chemistry, The Molecular Nature of Matter and Change, Martin S. Silberberg, 2000.
Deret Volta:
K Ba Ca Na Mg Al Mn Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
<-------------------------- ------------------------------------------>
mudah mengalami oksidasi...................................mudah mengalami reduksi
(reduktor)......................................................................(oksidator)
Reaksi perkiraan:
L(s) + M+(aq) -->L+(aq) + M(s)
Reaksi ini berlangsung dengan syarat logam L terletak di sebelah kiri dari logam M. Reaksi ini disebut juga reaksi pendesakan dalam deret volta dengan pengertian logam L yang bebas (atomik) di sebelah kiri mendesak logam M yang terikat (bentuk ion/garam) di sebelah kanan. Logam L yang mendesak lebih aktif dibanding logam M yang didesak.
Contoh reaksi berlangsung:
Mg(s) + Zn2+ (aq)---> Mg2+ (aq) + Zn(s)
Ni(s) + Pb(NO3)2(aq)---> Ni(NO3)2(aq) + Pb(s)
Fe(s) + 2 Ag+(aq)---> Fe2+(aq) + 2 Ag(s)
NiSO4(aq) + Zn(s) Ni(s) + ZnSO4(aq)
Cu2+(aq) + Ca(s)---> Cu(s) + Ca2+(aq)
Perhatikan logam bebas (atomik) mendesak logam terikat (bentuk ion/
garam). Dalam deret volta semua logam bebas berada di sebelah kiri logam
terikat. Jika kelima contoh reaksi di atas dihitung potensial selnya, maka
akan bertanda positif.
Contoh reaksi tidak berlangsung:
Ni(s) + Zn2+(aq) ..............tidak terjadi reaksi
2 Ag(s) + FeSO4(aq)........ tidak terjadi reaksi
Pb(s) + MnSO4(aq)...........tidak terjadi reaksi
Ni2+(aq) + Cu(s)................ tidak terjadi reaksi
ZnSO4(aq) + Sn(s)............ tidak terjadi reaksi
Perhatikan logam bebas (atomik) berada di sebelah kanan logam terikat (bentuk ion/garam) dalam deret volta. Berarti kelima reaksi di atas tidak berlangsung (tidak terjadi reaksi). Jika dihitung potensial sel, maka akan berharga negatif.
Sumber: Chemistry, The Molecular Nature of Matter and Change, Martin S. Silberberg, 2000.
Deret Volta:
K Ba Ca Na Mg Al Mn Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
<-------------------------- ------------------------------------------>
mudah mengalami oksidasi...................................mudah mengalami reduksi
(reduktor)......................................................................(oksidator)
Reaksi perkiraan:
L(s) + M+(aq) -->L+(aq) + M(s)
Reaksi ini berlangsung dengan syarat logam L terletak di sebelah kiri dari logam M. Reaksi ini disebut juga reaksi pendesakan dalam deret volta dengan pengertian logam L yang bebas (atomik) di sebelah kiri mendesak logam M yang terikat (bentuk ion/garam) di sebelah kanan. Logam L yang mendesak lebih aktif dibanding logam M yang didesak.
Contoh reaksi berlangsung:
Mg(s) + Zn2+ (aq)---> Mg2+ (aq) + Zn(s)
Ni(s) + Pb(NO3)2(aq)---> Ni(NO3)2(aq) + Pb(s)
Fe(s) + 2 Ag+(aq)---> Fe2+(aq) + 2 Ag(s)
NiSO4(aq) + Zn(s) Ni(s) + ZnSO4(aq)
Cu2+(aq) + Ca(s)---> Cu(s) + Ca2+(aq)
Perhatikan logam bebas (atomik) mendesak logam terikat (bentuk ion/
garam). Dalam deret volta semua logam bebas berada di sebelah kiri logam
terikat. Jika kelima contoh reaksi di atas dihitung potensial selnya, maka
akan bertanda positif.
Contoh reaksi tidak berlangsung:
Ni(s) + Zn2+(aq) ..............tidak terjadi reaksi
2 Ag(s) + FeSO4(aq)........ tidak terjadi reaksi
Pb(s) + MnSO4(aq)...........tidak terjadi reaksi
Ni2+(aq) + Cu(s)................ tidak terjadi reaksi
ZnSO4(aq) + Sn(s)............ tidak terjadi reaksi
Perhatikan logam bebas (atomik) berada di sebelah kanan logam terikat (bentuk ion/garam) dalam deret volta. Berarti kelima reaksi di atas tidak berlangsung (tidak terjadi reaksi). Jika dihitung potensial sel, maka akan berharga negatif.
Label:
Reaksi Oksidasi Reduksi
Kamis, 11 Agustus 2011
Cara Download Video di Youtube
Video merupakan salah satu media pembelajaran yang dapat digunakan, jika guru kesulitan menjelaskan materi yang bersifat abstrak, misalnya struktur atom ,proses ikatan kimia atau bentuk molekul. Banyak video kimia di internet yang bisa diunduh misalnya di situs terkenal You Tube.com. Banyak software yang dapat digunakan ,diantaranya adalah You Tube downloader yang dapat diunduh disini. Setelah menginstal dan program sudah jalan, alamat url dari video itu dikopi , paste pada programnya ,dan klik download
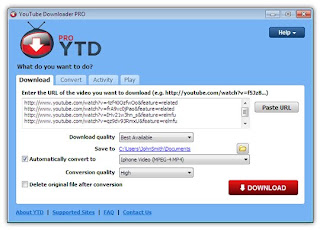
Sofware ini juga dapat sebagai converter dai flv menjadi wmv.
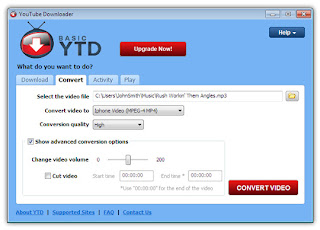
Cara kedua adalah dengan Internet Download manager (IDM) yang dapat didownload di sini
software ini masih dalam bentuk Betha. Selelah diinstal
Selanjutnya, silahkan buka Youtube, cari file yang akan anda download.
Setelah anda menemukan video dari Youtube (termasuk di situs lainnya juga) dan ingin mendownload-nya maka tinggal klik saja Download This Video (lihat gambar).
IDM juga dapat mengunduh video dari situs-situs yang lain. Dari berbagai cara mengunduh video You Tube, dua cara diatas adalah cara yang paling lancar dan mudah bagi penulis
Label:
Video Kimia Youtube
Video Ikatan Kimia
Ikatan Kovalen
Ikatan Ion
Ikatan Kovalen Polar
Ikatan Logam
Hibridisasi
Ikatan Ion
Ikatan Kovalen Polar
Ikatan Logam
Hibridisasi
Label:
Video Kimia Youtube
Video Teori Model Atom
Model Atom Dalton
Model Atom Thompson
Percobaan Rutherford
Percobaan Milikan
Percobaan Tabung Katoda
Percobaan Tabung Crook
Model Atom Niels Bohr
Semua Teori model Atom
Model Atom Thompson
Percobaan Rutherford
Percobaan Milikan
Percobaan Tabung Katoda
Percobaan Tabung Crook
Model Atom Niels Bohr
Semua Teori model Atom
Label:
Video Kimia Youtube
Selasa, 09 Agustus 2011
Sel Volta
Luigi Galvani (1780) dan Alessandro Volta (1800) telah menemukan terbentuknya arus listrik dari reaksi kimia. Reaksi kimia yang terjadi merupakan reaksi redoks (reduksi dan oksidasi) dan alat ini disebut sel volta.
1. Proses
Logam tembaga dicelupkan dalam larutan CuSO4 (1 M) dan logam seng dicelupkan dalam larutan ZnSO4 (1 M). Kedua larutan dihubungkan dengan jembatan garam.
Jembatan garam merupakan tabung U yang diisi agar-agar dan garam KCl. Sedangkan
kedua elektrode (logam Cu dan logam Zn) dihubungkan dengan alat penunjuk arus yaitu
voltmeter. Logam Zn akan melepaskan elektron dan berubah membentuk ion Zn2+ dan bergabung dalam larutan ZnSO4 . Elektron mengalir dari elektrode Zn ke elektrode Cu. Ion Cu2+ dalam larutan CuSO4 menerima elektron dan ion tersebut berubah membentuk endapan logam Cu.
Reaksinya dapat digambarkan:
Reaksi oksidasi : Zn ⎯⎯ → Zn2+ + 2 e–
Reaksi reduksi : Cu2++ 2 e– ⎯⎯ → Cu
__________________________+
Reaksi bersih pada sel : Zn + Cu2+ --> Zn2+ + Cu
Penulisan dapat disingkat Zn | Zn2+ || Cu2+ || Cu
2.Elektrode pada Sel Volta
Katode :
- Elektrode di mana terjadi reaksi reduksi, berarti logam Cu.
- Dalam sel volta disebut sebagai elektrode positif.
Anode :
- Elektrode di mana terjadi reaksi oksidasi, berarti logam Zn.
- Dalam sel volta disebut sebagai elektrode negatif.
3.Fungsi Jembatan Garam
Dalam larutan ZnSO4 terjadi kenaikan jumlah ion Zn2+ dan dalam larutan
CuSO4 terjadi penurunan jumlah ion Cu2+. Sedangkan banyaknya kation (Zn2+ atau Cu2+) harus setara dengan anion . Untuk menyetarakan kation dan anion, maka ke dalam larutan ZnSO4 masuk anion Cl– dari jembatangaram sesuai bertambahnya ion Zn2+.Pada larutan CuSO4 terjadi kekurangan Cu2+ atau dapat disebut terjadi kelebihan ion , maka ion masuk ke jembatan garam menggantikan Cl– yang masuk ke larutan ZnSO4. Jadi, fungsi jembatan garam adalah menyetarakan kation dan anion dalam larutan.
4. Potensial Elektrode
Banyaknya arus listrik yang dihasilkan dari kedua elektrode di atas dapat ditentukan besarnya dengan menetapkan potensial elektrode dari Zn dan Cu. Hanya saja potensial elektrode suatu zat tidak mungkin berdiri sendiri, harus ada patokan yang menjadi standar. Sebagai elektrode standar digunakan elektrode hidrogen. Elektrode ini terdiri atas gas hidrogen murni dengan
tekanan 1 atm pada suhu 25 ºC yang dialirkan melalui sepotong platina yang tercelup dalam suatu larutan yang mengandung ion H+sebesar 1 mol/liter.
Potensial elektrode hidrogen standar diberi harga = 0 volt (Eº = 0 volt).
Reaksi:
2 H+(aq) + 2 e– --> H2 (g); ΔH = 0 volt Eº = 0 volt
Menurut perjanjian internasional, jika ada suatu zat ternyata lebih mudah
melakukan reduksi dibanding hidrogen, maka harga potensial elektrodenya
adalah positif. Potensial reduksinya positif.
Cu 2+(aq) + 2 e– --->Cu(s); Eº = + 0,34 volt
Ag+(aq) + e– --->Ag(s); Eº = + 0,80 volt
Tetapi jika zat ternyata lebih mudah melakukan reaksi oksidasi dibanding
hidrogen, maka harga potensial elektrodenya adalah negatif. Dalam hal ini
potensial oksidasinya positif, tetapi karena potensial elektrode harus ditulis
reduksi berarti potensial reduksinya adalah negatif.
Zn2+(aq) + 2 e– --->Zn(s); Eº = 0,76 volt
A13+(aq)+ 3 e– --->A1(s); Eº = 1,76 volt
Jadi, potensial elektrode digambarkan dengan reaksi reduksi.

http://ora24.cafe24.com/Science/Volta.htm
Berikut daftar harga potensial elektrode untuk logam-logam yang penting.

Label:
Reaksi Oksidasi Reduksi
Perhitungan Potensial Sel
Besarnya potensial sel dari suatu reaksi redoks dalam sel volta merupakan total dari potensial elektrode unsur-unsur sesuai dengan reaksinya.
Dalam hal ini, hasil perhitungan potensial sel bisa positif atau bisa negatif. Jika potensial sel bertanda positif berarti reaksi dapat berlangsung, sedangkan jika potensial sel bertanda negatif berarti reaksi tidak dapat berlangsung.
E°sel= E°(+)– E°(–)
dengan:
E°(+)= potensial elektrode lebih positif (lebih besar)
E°(–)= potensial elektrode lebih negatif (lebih kecil)
Perhitungan tidak melibatkan koefisien.
Contoh Soal
1. Diketahui : Cu2+ + 2 e– ⇒Cu E° = – 0,34 V
Ag+ + e– ⇒Ag E° = + 0,80V
Tentukan Eo sel
dari kedua elektrode!
Jawab:
E°Cu lebih negatif dari E°Ag
, maka Cu mengalami oksidasi dan bertindak sebagai anode
Katode : Ag+ + e–⇒Ag E° = + 0,80 V
Anode : Cu ⇒Cu2+ + 2 e– E° = – 0,34 V
_____________________________+
2 Ag+ + Cu ⇒2 Ag + Cu 2+ E°sel= + 0,46 V
2. Diketahui:
Ag+ + e– ⇒Ag Eº = + 0,80 V
A13+ + 3 e– ⇒Al Eº = – 1,66V
Tentukan Eº sel dari elektrode Ag dan Al serta tentukan katode dan anode!
Jawab:
E°sel= E°(+) – E°(–)
= E°Ag – E°Al
= (+0,80) – (–1,66)
= +2,46 V
Katode = elektrode positif, cari E° yang lebih positif(E°(+)), yaitu Ag.
Anode = elektrode negatif, cari E° yang lebih negatif (E°(–)), yaitu Al.
3. Diketahui: Fe2+ + 2 e–⇒Fe E° = –0,44 V
A13+ + 3 e⇒Al E° = –1,66 V
a. Tentukan E°sel dari elektrode A1 dan Fe!
b. Tentukan katode dan anode!
c. Bagaimana reaksi sel?
d. Tentukan elektrode yang bertambah dan elektrode yang berkurang!
e. Tentukan larutan ion yang makin pekat dan larutan ion yang makin encer!
Jawab:
E° lebih positif/lebih besar (E°(+))= E°Fe
E° lebih negatif/lebih kecil (E°(–) )= E°Al
a. E sel= E° (+) – E° (–)
= E°Fe – E°Al
= (–0,44) – (–1,66)
= + 1,22 V
b. Katode = E° (+)= besi
Anode = E° (–)= aluminium
c. Reaksi sel
Reaksi reduksi untuk E°(+), yaitu untuk Fe dan reaksi oksidasi untuk E°(–),yaitu untuk Al.
Fe2+ + 2 e-⇒Fe ⇒ × 3
Al⇒A13+ + 3 e–⇒ × 2
____________________+
3 Fe2+ + 2 Al⇒ 3 Fe + 2 Al3+
d. Elektrode yang bertambah pada hasil reaksi, yaitu Fe.
Elektrode yang berkurang pada pereaksi, yaitu Al.
e. Larutan ion yang makin pekat pada hasil reaksi, yaitu ion A13+
.Larutan ion yang makin encer pada pereaksi, yaitu ion Fe2+
4. Diketahui:
E° Ag+/Ag = + 0,80 V
E° Cu2+/Cu = + 0,34 V
E° Pb2+/Pb = – 0,13 V
E° Fe2+/Fe = – 0,44 V
E° Zn2+/Zn = – 0,76 V
Manakah dari reaksi sel berikut yang mempunyai potensial sel terbesar?
A. Pb2+ /Pb// Zn/Zn2+
B. Cu2+ /Cu// Fe/Fe2+
C. Ag+/Ag// Fe/Fe2+
D. Ag+/Ag// Zn/Zn2+
E. Fe2+/Fe// Zn/Zn2+
Jawab: D
Potensial terbesar terjadi dari potensial reduksi paling positif (EºAg) dengan potensial
reduksi paling negatif (E°Zn) serta reaksi Ag harus reduksi dan reaksi Zn harus oksidasi
Dalam hal ini, hasil perhitungan potensial sel bisa positif atau bisa negatif. Jika potensial sel bertanda positif berarti reaksi dapat berlangsung, sedangkan jika potensial sel bertanda negatif berarti reaksi tidak dapat berlangsung.
E°sel= E°(+)– E°(–)
dengan:
E°(+)= potensial elektrode lebih positif (lebih besar)
E°(–)= potensial elektrode lebih negatif (lebih kecil)
Perhitungan tidak melibatkan koefisien.
Contoh Soal
1. Diketahui : Cu2+ + 2 e– ⇒Cu E° = – 0,34 V
Ag+ + e– ⇒Ag E° = + 0,80V
Tentukan Eo sel
dari kedua elektrode!
Jawab:
E°Cu lebih negatif dari E°Ag
, maka Cu mengalami oksidasi dan bertindak sebagai anode
Katode : Ag+ + e–⇒Ag E° = + 0,80 V
Anode : Cu ⇒Cu2+ + 2 e– E° = – 0,34 V
_____________________________+
2 Ag+ + Cu ⇒2 Ag + Cu 2+ E°sel= + 0,46 V
2. Diketahui:
Ag+ + e– ⇒Ag Eº = + 0,80 V
A13+ + 3 e– ⇒Al Eº = – 1,66V
Tentukan Eº sel dari elektrode Ag dan Al serta tentukan katode dan anode!
Jawab:
E°sel= E°(+) – E°(–)
= E°Ag – E°Al
= (+0,80) – (–1,66)
= +2,46 V
Katode = elektrode positif, cari E° yang lebih positif(E°(+)), yaitu Ag.
Anode = elektrode negatif, cari E° yang lebih negatif (E°(–)), yaitu Al.
3. Diketahui: Fe2+ + 2 e–⇒Fe E° = –0,44 V
A13+ + 3 e⇒Al E° = –1,66 V
a. Tentukan E°sel dari elektrode A1 dan Fe!
b. Tentukan katode dan anode!
c. Bagaimana reaksi sel?
d. Tentukan elektrode yang bertambah dan elektrode yang berkurang!
e. Tentukan larutan ion yang makin pekat dan larutan ion yang makin encer!
Jawab:
E° lebih positif/lebih besar (E°(+))= E°Fe
E° lebih negatif/lebih kecil (E°(–) )= E°Al
a. E sel= E° (+) – E° (–)
= E°Fe – E°Al
= (–0,44) – (–1,66)
= + 1,22 V
b. Katode = E° (+)= besi
Anode = E° (–)= aluminium
c. Reaksi sel
Reaksi reduksi untuk E°(+), yaitu untuk Fe dan reaksi oksidasi untuk E°(–),yaitu untuk Al.
Fe2+ + 2 e-⇒Fe ⇒ × 3
Al⇒A13+ + 3 e–⇒ × 2
____________________+
3 Fe2+ + 2 Al⇒ 3 Fe + 2 Al3+
d. Elektrode yang bertambah pada hasil reaksi, yaitu Fe.
Elektrode yang berkurang pada pereaksi, yaitu Al.
e. Larutan ion yang makin pekat pada hasil reaksi, yaitu ion A13+
.Larutan ion yang makin encer pada pereaksi, yaitu ion Fe2+
4. Diketahui:
E° Ag+/Ag = + 0,80 V
E° Cu2+/Cu = + 0,34 V
E° Pb2+/Pb = – 0,13 V
E° Fe2+/Fe = – 0,44 V
E° Zn2+/Zn = – 0,76 V
Manakah dari reaksi sel berikut yang mempunyai potensial sel terbesar?
A. Pb2+ /Pb// Zn/Zn2+
B. Cu2+ /Cu// Fe/Fe2+
C. Ag+/Ag// Fe/Fe2+
D. Ag+/Ag// Zn/Zn2+
E. Fe2+/Fe// Zn/Zn2+
Jawab: D
Potensial terbesar terjadi dari potensial reduksi paling positif (EºAg) dengan potensial
reduksi paling negatif (E°Zn) serta reaksi Ag harus reduksi dan reaksi Zn harus oksidasi
Label:
Reaksi Oksidasi Reduksi
Minggu, 12 Juni 2011
Ulangan Minyak Bumi 2
1. Jelaskan proses pembentukan minyak bumi!
2. Sebutkan fraksi minyak bumi beserta kegunaanya ! minimal 4
3. Sebutkan fraksi minyak bumi yang mempunyai titik didih paling rendah dan titik didih paling tinggi beserta kegunaannya!
4. Jelaskan apa yang dimaksud dengan nilai oktan!
5. Jelaskan 3 cara untuk meningkatkan nilai oktan pada bensin
6. Jelaskan apa yang dimaksud bensin dengan nilai oktan 88!
7. Jelaskan dampak negatif dari TEL yang ditambahkan pada bensin!
8. Jelaskan dampak negatif dari hasil pembakaran tidak sempurnna dari bensin!
9. Apakah yang disebut dengan ”Green House Effect! Jelaskan proses terjadinya?
10.Sebutkan 3 cara mengatasi pemanasan global!
2. Sebutkan fraksi minyak bumi beserta kegunaanya ! minimal 4
3. Sebutkan fraksi minyak bumi yang mempunyai titik didih paling rendah dan titik didih paling tinggi beserta kegunaannya!
4. Jelaskan apa yang dimaksud dengan nilai oktan!
5. Jelaskan 3 cara untuk meningkatkan nilai oktan pada bensin
6. Jelaskan apa yang dimaksud bensin dengan nilai oktan 88!
7. Jelaskan dampak negatif dari TEL yang ditambahkan pada bensin!
8. Jelaskan dampak negatif dari hasil pembakaran tidak sempurnna dari bensin!
9. Apakah yang disebut dengan ”Green House Effect! Jelaskan proses terjadinya?
10.Sebutkan 3 cara mengatasi pemanasan global!
Label:
Soal-Soal
Langganan:
Postingan (Atom)












